Lompart Grażyna
CZĘśĆ I
- Podane związki zakwalifikuj do odpowiedniej grupy, wpisując wzór związku obok nazwy grupy:
FeS, Zn(OH)2, HNO3, Mg3N2, CaC2, H2O, OF2, Cu(NO3)2, NH3, N2O3, AlH3, KOH, NaCl
TLENKI WODOROTLENKI
WODORKI SOLE
KWASY INNE
- Wskaż zbiór tlenków będących wyłącznie tlenkami kwasowymi
- CO, ZnO, Cl2O7
- P2O5, MgO, N2O3
- CO2, N2O5, SO2
- CaO, SO3, Na2O
- CO, ZnO, Cl2O7
- Uzupełnij równania reakcji:
- P2O5 + H2O →
- K2O + H2O →
- CO2 + H2O →
- P2O5 + H2O →
- Siarczan (IV) żelaza (III) ma wzór?
A. FeSO4 C. Fe2(SO4)3
B. FeSO3 D. Fe2(SO3)3
- Uzupełnij równania reakcji zachodzących w roztworze wodnym:
A.
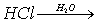
B.
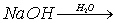
- Narysuj wzór strukturalny kwasu azotowego (V)
- Wybierając substraty z podanych związków napisz trzy równania reakcji otrzymywania soli: Ca(OH)2, SO3, Na2O, HNO3
-
-
-
- Uzupełnij zdanie:
Wodorotlenek glinu jest wodorotlenkiem …………………….., dlatego reaguje z mocnymi …………………….. i mocnymi ………………….. .
CZĘśĆ II
- Mangan może tworzyć różne tlenki, np. MnO, MnO2, Mn2O7.
Określ charakter każdego tlenku:
MnO – to tlenek ………………….
MnO2 – to tlenek ………………..
Mn2O7 – to tlenek ………………
- Jakie właściwości Cr(OH)3 obrazuje poniższy schemat?
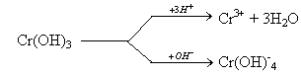
A. redukujące B. utleniające C. amfoteryczne D. wszystkie odp. są poprawne
- Narysuj wzór elektronowy kwasu siarkowego (VI) i określ rodzaje wiązań.
- Pewien metal przereagował z kwasem, ale w reakcji nie wydzielił się wodór. Substratami reakcji mogły być:
A. cynk i kwas solny C. Miedź i kwas azotowy(V)
B. magnez i roztwór kwasu siarkowego D. Miedź i kwas solny
- Z podanych właściwości podkreśl te, które są charakterystyczne dla wodorotlenku sodu:
ciało stałe, gaz, higroskopijny, zielony, nie ma właściwości żrących
- Jakie wodorosole może tworzyć kwas fosforowy (V). Podaj wzory i nazwy przykładowych wodorosoli tego kwasu.
CZĘśĆ III
- Ile gramów wodorotlenku sodu potrzeba do całkowitego usunięcia tlenku siarki (IV) z 20dm3 powietrze (warunki normalne), w którym znajduje się 1,5% (objętościowo) tlenku siarki (IV). Tlenek siarki (IV) przechodzi w wodorosiarczan (IV).
- Napisz równania reakcji zaznaczonych w poniższym schemacie:
![]()
1)…………………………………………..
2)…………………………………………..
3)…………………………………………..
- Pewien pierwiastek tworzy dwuprotonowy kwas tlenowy o masie cząsteczkowej 62u, w którym stosunek wagowy tlenu do wodoru wynosi 24:1. Podaj wzór tego kwasu.
- Podaj przykład soli, którą należy rozpuścić w wodzie, aby stosunek molowy kationów do anionów w roztworze wynosił 2:3. Napisz dysocjację tej soli
CZĘśĆ IV
- Do 400g 5%roztworu NaOH dodano 100cm3 0,25M H2SO4.
Jaką barwę przyjmie oranż metylowy po tej reakcji?
Odpowiedź uzasadnij obliczeniami.
- Jakie związki chemiczne kryją się pod symbolami a, b, c, d na poniższym schemacie: kwas, wodorotlenek, zasada, sól.
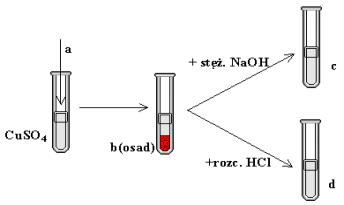
3. W których probówkach zajdą reakcje, które można zapisać tylko równaniem:
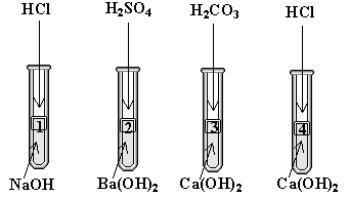
Tlenki, wodorotlenki, kwasy, sole
– wielopoziomowy sprawdzian wiadomości
INFORMACJE dla ucznia
……………………. ……………..
nazwisko i imię klasa
1. Czas pracy: 45 minut.
2. Sprawdzian zawiera 4 części pytań:
– część 1-8 pytań;
– część 11-6 pytań;
– część III – 4 pytania;
– część IV – 3 pytania.
3. Wszystkich odpowiedzi należy udzielać tylko w arkuszu z zadaniami.
4. Do arkusza dołączony jest brudnopis, który możesz wykorzystać na własne notatki. Odpowiedzi do pytań oraz rozwiązania zadań znajdujące się w brudnopisie nie będą punktowane.
5. Praca jest samodzielna. Korzystanie z niedozwolonych form pomocy kończy się wpisaniem oceny niedostatecznej ze sprawdzianu.
6. Podczas sprawdzianu nie wolno korzystać z układu okresowego pierwiastków.
7. Można korzystać z kalkulatorów prostego typu.
8. Podczas pracy nauczyciel udziela tylko informacji dotyczących wartości mas atomowych pierwiastków. Innych informacji nauczyciel nie udziela.
9. Za rozwiązanie wszystkich zadań można otrzymać łącznie 50 punktów.
10. Odpowiedzi należy pisać dokładnie i czytelnie.
11. Należy używać tylko niebieskiego lub czarnego długopisu albo pióra. Nie wolno używać korektorów.
12. W testach wyboru nie wolno skreślać. W pozostałych pytaniach skreślenia są dopuszczalne. Błędny fragment powinien być wyraźnie skreślony, a przekreślenie podpisane.
13. Wskazówki dotyczące odpowiedzi w pytaniach testowych (testy wyboru):
a) za odpowiedź uczeń otrzymuje O lub l punkt. Nie ma punktów ułamkowych;
b) w testach wyboru poprawne odpowiedzi zaznaczamy kółeczkiem. Zanim wybierzesz odpowiedź, uważnie się zastanów. Gdy w zadaniu testowym będą skreślenia, otrzymujesz za to pytanie O punktów;
c) poprawna jest tylko jedna odpowiedź.
14. Punktacja za poszczególne zadania.
Część I zad.1 – 6p., zad.2 – 1p., zad.3 – 3p., zad.4 – 1p., zad.5 – 2p., zad.6 – 1p., zad.7 – 3p,
Zad.8 – 2p.
Część II zad.1 – 3p., zad.2 – 1p., zad.3 – 4p., zad.4 – 1p., zad.5 – 2p., zad.6 – 2p.
Część III zad.1 – 3p., zad.2 – 3p., zad.3 – 2p., zad.4 – 2p.
Część IV zad.1 – 2p., zad.2 – 4p., zad.3 – 2p.
Przeliczanie punktów na oceny:
Ilość punktów Ocena
0-14 niedostateczna
15-26 dopuszczająca
27-36 dostateczna
37-45 dobra
46-50 bardzo dobra
Arkusz wyników sprawdzianu
Wielopoziomowy sprawdzian wiadomości: tlenki, wodorotlenki, kwasy, sole.
| Część | Nr zadania | Punkty |
I | 1. 2. 3. 4. 5. 6. 7. 8. | |
II |
1. 2. 3. 4. 5. 6.
| |
III | 1. 2. 3. 4.
| |
IV |
1. 2. 3.
| |
| suma punktów | ||
| ocena |
………………..………. …………….
nazwisko i imię klasa
Tabelę wypełnia nauczyciel.
Uzyskane punkty
Uwagi:
(wypełnia nauczyciel)
………………………………………………………………………………
podpis nauczyciela






![O Tajlandii, Kambodży i Wietnamie w bibliotece w Markowicach [ZDJĘCIA] O Tajlandii, Kambodży i Wietnamie w bibliotece w Markowicach](https://raciborz.com.pl/wp-content/uploads/2026/02/Azja-Joanna-Lyko-Dominik.jpg)
![Ferie pełne wyobraźni. Warsztaty z Ciocią od Klocków na Zamku Piastowskim [ZDJĘCIA] Ferie pełne wyobraźni. Warsztaty z Ciocią od Klocków na Zamku Piastowskim](https://raciborz.com.pl/wp-content/uploads/2026/02/zamek-piastowski-ferie-zimowe-cioca-od-klockow.jpg)







![Zima pełna pasji. Taneczne i kreatywne ferie w Raciborskim Centrum Kultury [ZDJĘCIA] Zima pełna pasji. Taneczne i kreatywne ferie w Raciborskim Centrum Kultury](https://raciborz.com.pl/wp-content/uploads/2026/02/ferie-rck-taniec.jpg)
![Komiksowe ferie w raciborskiej bibliotece. Pierwszy tydzień pełen przygód [ZDJĘCIA]](https://raciborz.com.pl/wp-content/uploads/2026/02/biblioteka-ferie-zimowe.jpg)



![Hałas, śmieci i zniszczenia. List do Redakcji oraz komentarz właścicielki „Końca Świata” – AKTUALIZACJA [ZDJĘCIA]](https://raciborz.com.pl/wp-content/uploads/2025/12/przystanek-kulturalny-koniec-swiata-2-1.jpg)








